Experiencias en el aula.
En el curso 2024/25 comenzamos a realizar algunas experiencias en el aula. La primera estaba relacionada con el proyecto que el IES Torre de los Guzmanes de La Algaba (Sevilla) va a presentar en la próxima edición de la Feria de la Ciencia de Sevilla.
El día 6 de noviembre de 2024 realizamos una presentación ante el profesorado y alumnado que se encargará de llevar a cabo el proyecto. Conjuntamente con el visionado de la presentación que se adjunta, fuimos simulando el proceso para que quedaran claras todas las acciones que seguirán de acuerdo con el protocolo elegido.
.Pulsando sobre las imágenes puede acceder al documento correspondiente.
 Guión de la presentación. |
 Presentación |
 Protocolos |
Las imágenes siguientes nos muestran algunos detalles, así como una foto de grupo y otra recogiendo un obsequio (*) que cariñosamente me habían preparado.
 |
 |
 |
 |
 |
 |
 |
 |
(*) Unas mandarinas ecológicas producidas en la zona, que por cierto estaban exquisitas.










 ulación y corte.
ulación y corte.

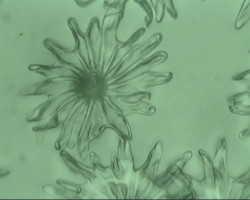
 Realización de las preparaciones:
Realización de las preparaciones: